ביוטכנולוגיה/מעבדות/קינטיקה של האנזים עמילז
הקדמה
[עריכה]חזרה כללית על פרק אנזים מספר ביוכימיה
חשיבות האנזים
[עריכה]- ויסות ובקרה.
- אחראי לתהליכים כימיים בתא.
- יכול לשמש כזר. יתרונותיו וחסרונותיו הן שהוא פועל בטמפרטורה מתונה, ספציפית וחד שלבי.
פעילות אנזים
[עריכה]מהירות התגובה
[עריכה]קצב הופעת התוצרים או קצב העלמות המגיבים. 2 תכונות :
- מהירות תגובה שונה בין ריאקציות שונות.
- במהלך הניסוי, מהירות התגובה הולכת ונחלשת.
מעקב ישיר
[עריכה](על פי מהירות התגובה) ניתן בניסוי לעקוב אחר פעילות של אנזים ב-2 דרכים :
- העלמות מגיבים – קצב פעילותו יבוטא בשינוי ריכוז התוצר (ביחידות זמן).
- הופעת תוצרים - קצב פעילותו יבוטא בעליה בריכוז התוצר (ביחידות זמן)
מעקב עקיף
[עריכה]כאשר לא ניתן לעקוב באופן ישיר (למשל, כאשר החומרים שקופים ולכן לא מתקבל ערך בליעה בספקטרופוטומטר), יש להגיב את התוצרים/המצב (המגיבים) עם חומר נוסף שיאפשר מעכב. בבדיקה כזו, יש לעצור את פעילות האנזים לאחר זמן קבוע.
השפעתם של גורמים שונים על מהירות האנזים
[עריכה]יש ללמוד את כל פרק קינטיקה אנזימטית מספר ביוכימיה.זהו סיכום מקוצר של השפעת הגורמים על מהירות האנזים. הגורמים הם :
- טמפרטורה -שינוי טמפרטורה משפיע על KM. העלאת הטמפרטורה תביא לעליה בפעילות הקינטית. העלאה יתרה תביא לדנטורציה, תלוי אנזים (האנזים הוא חלבון).
- PH - משפיע על KM כיוון שמשנה את מטעני החלבון, דבר העלול לפגוע בפעילות האנזים. ערכי PH אופטימלי אינם מחייבים יציבות של אנזים.
- ריכוז האנזים - ככל שיש יותר אנזים, כך גדל כמות התוצר (יחס ישיר), בגלל ש : . בשלב מסויים כמות האנזים לא תשפיע כיוון שכל הסובסטרט פורק.
- ריכוז מצע - על פי (
| [s]<<<[Km] | |
| s=km | |
| v=vmax | s>>>km |
- מעכבים - מעכב תחרותי נקשר לאתר הפעיל ו-km יורד. Vmax זהה רק בערכי סובסטרט גדולים יותר (כלומר, זוהי אפשרות לתיקון התהליך). בדרך כלל מדובר במעכב ביולוגי שתפקידו לוסת ולבקר את פעילות האנזים. מעכב לא תחרותי נקשר לאתר הלא פעיל של האנזים km זהה ו-vmax קטן.
- חומרים דנטורטיביים
במעבדות השונות נלמד כיצד לקבוע עבור כל אנזים את הטמפרטורה האופטימלית, PH אופטימלי וכדומה.
קינטיקה של האנזים עמילאז
[עריכה]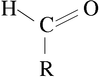
סוכר מחזר – כל הסוכרים האלדהידים הם סוכרים מחזרים. בסביבה בסיסית פרוקטוז (ממשפחת הקטונים) מתנהג כסוכר מחזר. סוכרים מחזרים שיש לדעת : גלוקוז, לקטוז ועוד.
טאוטומריה – כאשר קטון בסביבה בסיסית מתנהג כאלדהיד.
פולימר – שרשרת שנוצרת מרצף של מולקולות החוזרות על עצמן. למשל, חלבון הוא פולימר כיוון שהוא בנוי מרצף של חומצות אמינו.
עמילן – רב סוכר הוא פולימר, המורכב מיחידות גלוקוז החוזרות על עצמן. עמילן אינו סוכר מחזר.
עמילז – אנזים המפרק קשרים גליקוזידיים (= הקשר בין גלוקוז אחד לשני) בעמילן. ישנם 2 סוגי עמילז :
- עמילאז α – מפרק קשרים גליקוזידיים באופן אקראי.
- עמילאז β – מפרק קשרים גלידולזידיים לדו סוכר (= מלטוז ; מלטוז הוא דו סוכר מחזר). האנזים פועל בסביבה חומצית הנוצרת בהרתחה.
הניסוי
[עריכה]הניסוי התחלק לשני חלקים :
- חלק א' – בנית עקום כיול של מלטוז.
- חלק ב'- השפעת ריכוז המצע (עמילן) על פעילות האנזים β עמילז.
מטרת הניסוי : קביעת הערכים הקינטיים (Km, Vmax) של האנזים β עמילאז.
מגיבים (ריאגנטים) ותוצרים
[עריכה]- האנזים : B עמילאז.
- הסובסטרט : עמילן.
- אינדיקאטור : סמנר מבצע 2 פעולות בתגובה :
- עצירת התגובה - החומצה (סנמר) גורמת לחלבון (לאנזים) לעבור דנטורציה.
- אנדיקאטור - סמנר הא אנדיקאטור עבור חומר מחזר. בניסוי : סוכר מחזר + סמנר – קבלת צבע.
- התוצרים : מלטוז - מפירוק עמלין ע"י B עמילאז.
מהלך הניסוי בקצרה
[עריכה]חסר
חלק א' – בנית עקום כיול
[עריכה]מהלך הניסוי
[עריכה]- סדרה של מבחנות בעלות ריכוז עולה של התוצר (מלטוז).
- מיהול המבחנות במים - לקבלת מבחנות בעלות נפח שווה.
- הוספת סמנר - 2 הפעולות לעיל.
- חימום (הכנסה לאמבט) - לזירוז התהליך ולהיווצרות החומצה די נירי סליצלית (קיימת גם בסמנר עצמו).
- קירור (חובה) ומיהול (אם צריך – תלוי בעוצמת הצבע).
- איפוס ספקטרופוטומטר (אורך גל 540nm) – איפוס עם מבחנה בעלת סמנר בלבד, לקבלת תוצאות בהם יש 'נטו ערך בליעה של האנזים (ללא ערך בליעה של הסמנר).
- קבלת ערכי בליעה עולים – ככל שיש יותר סוכר מחזר, כך יווצר יותר צבע (מלטוז מגיב עם יותר סוכרים מחזרים), ולכן ערך הבליעה יהיה גבוה יותר.
בקור ואיפוס :
- מבחנה עם סנמר לאיפוס.
- עמילאז לבד לבדיקת פעילות האנזים.
הכנת עקום כיול במחשב
[עריכה]בסוף הניסוי, קיבלנו תוצאות של ערכי בליעה עבור מלטוז + מיהול. כיוון שאין אנו יודעים את ריכוז המלטוז לאחר המיהול, נבצע את הפעולה הבאה בכדי לקבל את ריכוז המלטוז (שהיה בעקבות המיהול) :C1V1=C2V2.
כיצד מבצעים את C1V1=C2V2
[עריכה]משום מה הרבה תלמידים מתבלבלים בנוסחא, אני מקווה שהשיטה שאני אציג תהיה קלה ומובנת יותר - חשוב לדעת להשתמש בנוסחא לבד, היא מופיעה הרבה בבגרות.
הנתונים
[עריכה]| מבחנות | ריכוז תמיסת מלטוז בנפח Y ובריכוז X | בליעה | ריכוז מלטוז שהתקבל |
|---|---|---|---|
| מספרים | 0.2 | לא חשוב | צריך לגלות |
הפעולות שמבצעים
[עריכה]א. רשימת הנתונים : מה שידוע -כותרת + מה שבכותרת :
- C1 - ריכוז מלטאוז שנתנה לנו במעבדה (הכותרת). בדוגמא : X (לא לשכוח יחידות הריכוז).
- V1 - נפח תמיסת מלטוז ששמנו (כל המספרים הרשומים בעמודה). בדוגמא : 0.2 (לא לשכוח את יחידות הנפח ה-Y).
מה שקיבלנו :
- V2 - נפח כולל בכלי.
- C2 - ריכוז מלטוז (נגלה על ידי חישוב).
ב. ביצוע הפעולות - הצבה וחישוב.
יצירת גרף
[עריכה]עתה, יש בידנו את ריכוז המלטוז וכן גם את ערכי הבליעה עבורו. ניצור גרף תחת השם עקום כיול. שיפוע הגרף (m) מציין את מהירות פעילות האנזים.
חלק ב' - השפעת ריכוז המצע על פעילות האנזים B עמילאז
[עריכה]כאשר β עמילאז מפרק עמילן, מתקבל התוצר – המלטוז. המלטוז הוא חסר צבע, ולכן, הבדיקה היא בדיקה עקיפה, כלומר; באמצעות הסמנר המגיב עם המלטוז, נוכל לדעת את כמות המלטוז.
במילים אחרות, יש יחס ישיר בין ריכוז המלטוז לערכי הבליעה. ככל שיש יותר מלטוז, כך צריך יותר סמנר, ולכן מתקבל יותר צבע (באופן גרפי; שני הגרפים עולים).
מהלך הניסוי
[עריכה]- 2 סדרות של מבחנות.
- הוספה לכל זוג מבחנות (מבחנה ראשונה מסדרה א ומחנה ראשונה מסדרה ב) נפח עמילן זהה.
- השלמה לנפח זהה עבור כל המבחנות.
- הוספה לסדרה א' בלבד את האנזים.
- לאחר 5 דקות הוספת סמנר לכל המבחנות - לעצירת פעילות האנזים וכאנדיקטור לסוכר המחזר שנוצר (מלטוז).
- הנחה במים רותחים - להיווצרות חומצה די ניטרי סליצלית (הקיימת גם בסמנר עצמו) וכן לזירוז התהליך.
- קירור, מיהול (אם צריך)
- ערך בליעה - האיפוס מתבצע באמצעות מבחנה עם אנזים בלבד.
ממוחשב - הכנת מיכאליס מנטן ולינואר ברק
[עריכה]- ריכוז העמילן – גם את העמילן מהלנו ולכן יש למצוא את ריכוזו על פי * הנוסחא : C1V1=C2V2.
- נטו בליעה של התוצר – כיוון שבניסוי זה היו לנו בקרות (סדרה ב' – הייתה ללא האנזים), עלינו להחסיר מבחנה א1-ב1 וכדומה.
- ריכוז מלטוז – קבלנו ערכי בליעה, עבור ערך מלטוז שאין אנו יודעים אותו. כיוון שבחלק א' בנו עקום כיול, נוכל להציב במשוואה של קו המגמה את ערך הבליעה (Y) ולגלות את ריכוז המלטוז (X).
- ריכוז המלטוז לדקה – בניסוי האנזים פעל למשך 5 דקות ולכן אנו נחלק את ריכוז המלטוז בחמש, על מנת לקבל את ערך ריכוז המלטוז (התוצר) שהתקבל עבור דקה אחת בלבד.
- מיכאליס מנטן - יצירת גרף על פי ערכי ריכוז מלטוז לדקה (מהירות – כמה נוצר מלטוז לדקה) וריכוז עמילן (מגיב). הגרף שיתקבל יהיה סיגמאטי, יש ליצור קו מגמה עבור הנקודות העולות בלבד.
- לינואר ברק – נבצע את הפעולה X:1 עבור X ריכוז המלטוז לדקה וX ריכוז העמילן. יצירת הגרף (אין לקחת את הנקודות היוצרות קו ישר בסוף הגרף, אלא רק נקודה אחת).
יישומים
[עריכה]- שימוש בנוסחא C1V1=C2V2 – בכל פעם בה נמהל חומר מסוים, יהיה עלינו לדעת להשתמש בנוסחא.
- בקרה המשמשת לאיפוס – בניסוי זה היו מספר בקרות :
- סדרה ב' (ללא אנזים) - שימש לבדיקת פירוק ספונטני של הסובסטרט ; לכן החסרנו את ערכם מערך סדרה א'. כמו גם היא בדקה את ערך בליעת הסמנר.
- מבחנה עם אנזים בלבד - בקרה הבודקת את פעילות האנזים. עמה אפסנו את הספקטרופוטומטר עבור 2 הניסויים. איפסנו עם מבחנה זו ולא עם סדרה ב' כיוון שמבחנה אפס היא ערך אותו יש להוריד עבור כלל המבחנות, לעומת, סדרה ב', אותה החסרנו על פי המבחנה המתאימה לה.
- יש לדעת לבצע חישובים Km, Vmax לפי מיכאליס מנטן (Vmax/2, קבלת ערך Y מסוים, נציב במשוואה של הישר ונקבל את X שהוא Km) ולפי לינואר ברק (אותו הדבר).
- פעילות האנזים מבוטאת בערך הבליעה ולכן יחידותיו יהיו O.D/min.
Vmax ו-Km בגרפים
[עריכה]יחס ישיר בין ריכוז הסובסטרט לערכי הבליעה
[עריכה]כפי שצויין, ניתן לקבוע מהירות תגובה של B עמילאז ע"י עשית גרף סובטרט (עמילן) כנגד או :
- הפרשי בליעה כנגד ריכוז סובסטרט (חלק א') - שינוי בריכוז מלטוז לדקה.
- מיכאליס מנטן (חלק ב')- הפרשי בליעה חלקי זמן התגובה.
כיוון שקיים יחס ישיר בין ריכוז הבליעה לריכוז התוצר. כלומר, כאשר יש עליה בריכוז התוצר, כך עולים ערכי הבליעה. במילים אחרות, שני הגרפים שהתקבלו צריכים להיות זהים בחלק הלינארי שלהם.
המרת הערכים
[עריכה]זו סוג שאלה המופיע לפעמים בבגרות. העקרון שלה אומר : יש תלמיד הרוצה לעשות ניסוי עבור Km וניסוי אחר עבור Vmax.
בגרף הראשון הוא קיבל ערכי בליעה (O.D/Min) מול סובסטרט (S).
הוא תירגם את הגרף הראשון וקיבל גרף שני בו יש מהירות (mg/S/min) מול סובסטרט (S).
השאלה : האם יכול לקבוע את הערכים הקנטיים באמצעות שני הגרפים? נמק.
התשובה :
- km - כן, ניתן לקבוע באמצעות 2 הגרפים כיוון ש-Km תלוי בריכוז סובסטרט ; אפיניות האנזים אינה משתנה.
- Vmax - לא, יהיה צורך להמיר את יחדות הגרף הראשון (O.D/Min) ליחדות של (mg/S/min). כיוון שיחדות מהירות אינן נקבעות על פי ערכי בליעה.
שאלות שמופיעות בבגרות
[עריכה]חסר

![{\displaystyle \ Vmax=[Et]km}](https://wikimedia.org/api/rest_v1/media/math/render/svg/187ca06cd9d0a40c6f028456ada450a55301744b)

![{\displaystyle V={Vmax}*{\frac {[s]}{Km}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bd704ceed8a081bd04cdbb078fd055bfcfcb7eef)
