כימיה לבגרות/קוטביות של מולקולה/דו קוטב מולקולארי/מולקולה פולארית
מראה
רקע וחזרה
[עריכה]כידוע, קשר יוני הוא קשר הנוצר בעקבות הפרש אלקטרו שליליות בין שני אטומים הגדול מ-1.7. בקשר כזה נוצר "מגנט" (קוטביות) כלומר צד אחד במולקולה חיובית ואילו הצד שני, היכן שהאלקטרונים רבים יותר, שלילי. זהו מצב אידאלי וקבוע כיוון שאטום אחד נתן את כל האלקטרונים שלו ואילו אטום שני קיבל את כולם ושניהם זכו לרמת ערכיות הזהה לגז אציל. זה הוא הקשר אותו יעדיפו רוב האטומים.
בקשר קוולנטי (או שיתופי) מצב זה שונה כיוון שהיסודות חולקים בניהם את האלקטרונים ואינן יכולים להגיע בו בזמן לרמת ערכיות הזהה לגז אציל. שני מצבים יכולים להיווצר:
- קשר קוולנטי לא פולרי (לא קוטבי) - חלוקה כמעט שוויונית של האורביטל (=מסלול של האלקטרון) המשותף והוא נוצר כאשר הפרשי רמת הערכיות הם בין 0-0.3.
- קשר קוולנטי פולרי (קוטבי) - בקשר כזה האלקטרונים נמצאים בשימוש רב יותר אצל יסוד אחד מאשר יסוד שני. הוא נוצר כאשר הפרשי רמת הערכיות הם בין 0.3-1.7.אם אטום מתחבר בקשר שכזה הוא יעדיף להיות בעל האלקטרו-שליליות הגדולה יותר בקשר מאחר והוא יזכה לזמן ממושך יותר של אקלטרונים אצלו מאשר האטום השני. בעקבות קשר זה נוצר לנו שוב "מגנט" מדומה (כמו בקשר יוני) למשך מספר שניות שגורם למולקולה להיות לא סימטרית, כיוון שצד אחת זוכה לזמן ממושך יותר של אלקטרונים מצד שני. קוטביות זו מסומנת באמצעות דלתה פלוס ומינוס.
- קשר קוולנטי פולרי בעקבות מבנה המולקולה - לא רק רמת האלקטרושליליות יכולה להשפיע על קוטביות אלא גם מבנה המולקולה. קשר קוולנטי אשר רמת האלקטרו שליליות קטנה מ-0.3, במבנים מסוים יכול ליצור קוטביות.
- מבנים שעלולים ליצור קוטביות. כאשר יש שני סוגים של אטומים, דהינו אטום מרכזי אליו קשורים אטומים זהים אזהי יש סימטריה ולכן אין קוטביות. אבל כאשר האטומים שונים (ובעיקר רמת האלקטרושליליות שלהם שונה) אזהי יש קוטביות במבנים אלו:
- קווי
- פרמידה
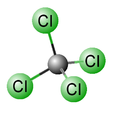
- טטראדרר - למשל במולקולה CH4 אין קוטביות אך ב-CH2Cl2 יש קוטביות.
- מבנים שיוצרים קוטביות:
- זוויתי עם "זוג גלמוד"
- משולש מישורי עם "זוג גלמוד"
- מבנים שעלולים ליצור קוטביות. כאשר יש שני סוגים של אטומים, דהינו אטום מרכזי אליו קשורים אטומים זהים אזהי יש סימטריה ולכן אין קוטביות. אבל כאשר האטומים שונים (ובעיקר רמת האלקטרושליליות שלהם שונה) אזהי יש קוטביות במבנים אלו:
- קשר קוולנטי פולרי בעקבות מבנה המולקולה - לא רק רמת האלקטרושליליות יכולה להשפיע על קוטביות אלא גם מבנה המולקולה. קשר קוולנטי אשר רמת האלקטרו שליליות קטנה מ-0.3, במבנים מסוים יכול ליצור קוטביות.

דוגמה
[עריכה]-
CCl4 היא מולקולה סימטרית כיוון שכל היסדות בעלי אנרגיית שליליות שווה.
-
Cl3H אינה מולקולה סימטרית כיוון שרמת האנרגיית שליליות בין היסודות שונים. בעקבות כך, המולקולה אינה סימטרית נוצר "מגנט" צד אחד הוא דלתה פלוס (H) ודלתה מינוס (Cl), אך כיוון, שהמגנט משתנה בכל כמה מאיות שניה מצד לצד הוא אינו סימטרי.
מסיסות
[עריכה]- קוטביות במולקולה משפיעה על יכול המסיסות במים. הדוגמה הנפוצה ביותר לכך היא מולקולת המים הקוטבית, שמצטיינת ביכולתה להמיס חומרים רבים.