כימיה לבגרות/מבנה מרחבי של מולקולה מולקולארית
רקע וחזרה
[עריכה]צורתה המרחבית של המולקולה הנוצרת בזכות יצירתו של קשר קוולנטי נקבעת על פי נטייתם של זוגות האלקטרונים להיות רחוקים זה מזה ככל הניתן בשל מטענם החשמלי השלילי (כלל האוטובוס). סביב כל אטום במולקולה כזו (מלבד מימן והליום) מצויים ארבעה אורביטלים (מבנה לואיס), היכולים להיות בלעדיים לאטום או משותפים בקשר קוולנטי.
לפיכך, ישנן כוחות דחיה ומשיכה בין האלקטרונים, היוצרים מבנה מרחבי.
מבנים מרחבים
[עריכה]קווי
[עריכה]קורה כאשר יש :
-
אטום מרכזי הקשור לשני אטומים נוספים (על האטום המרכזי אין אלקטרונים חופשים).
-
שני אטומים קשורים בניהם בקשר קוולנטי יחיד.
משולש מישורי
[עריכה]קורה כאשר יש: אטום מרכזי הקשור ל-3 אטומים ואין עליו אלקטרונים חופשיים ברמה האחרונה.
דוגמא :

זוויתי / כפוף
[עריכה]קורה כאשר יש : אטום מרכזי הקשור לשני אטומים. על האטום המרכזי יש שני זוגות אלקטרונים חופשיים ברמה האחרונה.
דוגמא :

הסבר : שלושת האטומים יוצרים צורה מישורית, אך כל זוגות האלקטרונים מפוזרים במרחב בצורת טטראדר. הזווית בין הקשרים היא זווית חדה, שכן כוח הדחייה של זוגות האלטרונים גדול יותר משל הקשר הקוולנטי.
פירמידה
[עריכה]קורה כאשר יש: אטום מרכזי הקשור לשלושה אטומים. על האטום המרכזי יש זוג אחד של אלקטרונים חופשיים ברמה האחרונה.
דוגמא :

הסבר :הזווית שבין כל שני קשרים קבועה, אך הזווית בין זוג האלטרונים 'השייך' לאטום (שתי הנקודות) גדולה מעט מהזווית בין כל שני קשרים.
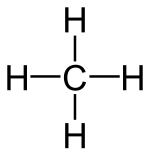
טטראדר
[עריכה]