כימיה לבגרות/יישום עקרונות
מהירות הריאקציה – נקבעת על פי קצב הופעת תוצרים או העלמות המגיבים ביחידת זמן. מהירות התגובה שונה בין ריאקציות שונות (תלוי בכמות החומרים) והיא הולכת ונחלשת ככל שעובר הזמן (בהנחה שלא משנים את התנאים - לא מוספים חומרים, לא מוצאים חומרים וכדומה).
חשיבות : מהירות תגובה = זמן --> כסף.
גורמים המשפיעים על מהירות תגובה
[עריכה]- טמפרטורה - משפיעה על קבוע שיווי משקל (K).
- זרז/קטליזטור -אינו משפיע על K.
כיצד נראה בגרף?
[עריכה]טמפרטורה
[עריכה]שינוי הדרגתי מאמצע הגרף. יתכן כי השינוי יחל מתחילת הגרף רק אם משווים אל גרף אחר.
 |
זרז
[עריכה]בדרך כלל, נתונים שני גרפים (או גרף מחובר). ההבדל בין הגרפים הוא בזמן שלקח למגיבים להפוך לתוצרים.
 |
תיאורית ההתנגשויות והתצמיד המשופעל
[עריכה]התאוריה מנסה לענות על השאלות : כיצד תגובות כימיות מתרחשות? מדוע יש הבדלים בין קצבי התגובה של תגובות שונות?
ההנחות המרכזיות בתאוריה :
- על מנת שהתגובה הכימית תתרחש, החלקיקים המעורבים בה צריכים להתנגש זה בזה.
- רק חלק ממספר ההתנגשויות הכולל בכל רגע נתון, המכונה ההתנגשויות הפוריות, גורם לשינוי של מולקולות המגיבים.

אנרגיה קינטית/אנרגיית תנועה (Ek)
[עריכה]האנרגיה שגוף רוכש כתוצאה מתנועתו, והיא תלויה רק במסת הגוף ובמהירותו. במילים אחרות, זוהי האנרגיה שבפעול יש למגיבים. כאשר למגיבים, תהיה כמות אנרגיה קינטית הזהה לכמות האנרגיה שהם צריכים על מנת להפוך לתוצרים (אנרגית השפעול); הם יוכלו "לחצות" את ההר ולהפוך לתוצרים.
אנרגיית אקטיבציה (שפעול; Ea)
[עריכה]"כמות" האנרגיה שצריכים המגיבים על מנת להפוך לתוצרים ("גבוה ההר").
הגדרה : היא האנרגיה המינימאלית הדרושה להתרחשות תגובה כימית מסוימת, או כמות האנרגיה שמולקולה מסוימת צריכה על מנת להגיב עם מולקולה.
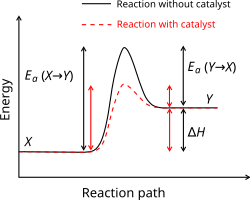
2 דרכים להגדלת מהירות התגובה :
- זרז – אינו חלק מהמערכת.מקטין את אנרגית הפעול.
- העלאת טמפרטורה – הגדלת האנרגיה הקינטית .
התנגשות פוריה
[עריכה]התנגשות מספיק חזקה שהמגיבים יצליחו ל"עבור" את ההר ולהפוך לתוצרים. לא כל ההתנגשויות יהיו פוריות ולכן רק התנגשות בה האנרגיה הקנטית גדולה/שווה לאנרגיית השפעול/אקטבציה מתקבל התנגשות פוריה.
יישום עקרונות (שיווי משקל, מהירות תגובה) בתעשיה
[עריכה]פרק זה לוקה בחסר. אתם מוזמנים לתרום לוויקיספר ולהשלים אותו. ראו פירוט בדף השיחה.
