כימיה לבגרות/אנרגיה
פרק זה, אנו מתמקדים בנושא אנרגיה אנתלפיה (H).
אנרגיה אנתלפיה היא אנרגיה של מערכת (תגובה כימית), הבאה לידי ביטוי בשינוי פיזי של הסביבה.
הסבר המונח: אנרגיה היא דבר שאינו מוחשי, אין ביכולתנו לראות אותו, אך, ניתן לראות את תוצאותיו. למשל : אנרגית חום בא לידי ביטוי ע"י העלאת טמפרטורת הסביבה. כאשר אנו מדברים באנרגיה אנתלפיה, אנו מדברים על אנרגיה הקיימת בתוך מערכת.
שלושת המצבים
[עריכה]קיימים שלושה שינויים של טמפרטורת הסביבה. על פי, שינוים אלו, אנו יכולים לדעת כמה אנרגיה נפלטה/התקבלה מיצרת תוצר, בתוך המערכת. האם המערכת הפסידה אנרגיה (שחררה אנרגיה לסביבה)? או שלהפך?; הרוויחה?.
| סביבה | מערכת (Hתוצר - Hמגיב = ΔH) | דוגמה | רווח/הפסד | |
|---|---|---|---|---|
| אקסותרמית | ΔT>0 | ΔH<0 | שריפה | הפסד/ שחרור אנרגיה - פירוק |
| אנדותרמית | ΔT<0 | ΔH>0 | מקרר | רווח/השקעת אנרגיה - בניה |
| אתרומית | ΔT=0 | ΔH=0 |
-
רמת האנרגיה של התגובה נמוכה משל המגיבים – כלומר, למגיבים יש יותר אנרגיה מאשר לתוצרים, ולכן, במהלך התגובה, כאשר המגיבים הופכים לתוצרים, משתחררת אנרגיה
-
רמת האנרגיה של התגובה גבוה משל המגיבים – כלומר, למגיבים יש פחות אנרגיה מאשר לתוצרים, ולכן, במהלך התגובה מושקעת אנרגיה
חישוב אנרגיה כימית
[עריכה]ישנן מספר דרכים לחישוב אנרגיה כימית (אנרגית חום).
חישוב אנרגית חום לתמיסה
[עריכה]במקרה שלנו, אנו רוצים לדעת כמה אנרגיה כימית צריכים להשקיע בכדי לשבור את הקשר בין מולקולות המים (שבירת קשר מתבצעת ע"י העלאת טמפרטורה) :
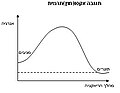
גרף
[עריכה]
אנתלפיה
[עריכה]אנו יכולים לומר כי : בכדי שקרח יהפוך למים אנו מנצלים אנרגית חום. אנרגית חום זו באה על חשבון הסביבה. כלומר : ΔT<0. לכן, ע"פ הטבלה שמוצגת למעלה, נוכל לומר כי הסביבה מפסידה, כלומר :ΔH>0.
שלושת הגורמים המשפיעים על חישוב אנרגית חום
[עריכה]מסה (m)
[עריכה]ככל שיש יותר מסה יש להשקיע יותר אנרגית חום (q).
בכתב כימי: qam (a - מסמלת על יחס ישיר בין שני חומרים)
הטמפרטורה אליה אנו רוצים להגיע (T)
[עריכה]ככל שאנו רוצים להגיע לטמפרטורה גבוהה יותר, כך, יש להשקיע יותר אנרגית חום.
סוג החומר/קיבול חום סגולי (C)
[עריכה]כמות החום שיש להשקיע באחד גרם חומר כדי לעלות בטמפרטורה צלזוס אחת. ככל ש-C נמוך יותר, החומר מתחמם מהר יותר, ולכן יש להשקיע פחות אנרגיה.
יחידות היחידה של J/gr*C°=ג'אול/גר*צלזיוס=C
יש לזכור את קיבול חום סגולי של מים שהם : 4.2J/grc.
הנוסחה
[עריכה]מכל שלושת הגורמים (מסה, טמפרטורה...) יצרו נוסחה והיא :
מקרא :
- m - מסה
- C - קיבולת חום סגולי.
- ΔT - הפרש טמפרטורה מהטמפרטורה שהינו לטמפרטורה שנרצה להגיע.
- q - אנרגית חום.
ΔHm ו- ΔHb
[עריכה]- ΔHm = אנתלפיה היתוך - כמות האנרגיה הדרושה להעברת אחד מול חומר מדוד ממוצק לנוזל.
- ΔHb = אנתלפיה רתיחה - כמות האנרגיה הדרושה להעברת אחד מול חומר מדוד מנוזל לגז.
בגלל שההפרש בין מעברים, כמו, מעבר ממוצק לנוזל, הוא אפס (בגרף : קו ישר) יצרו נוסחות למעברים שהן :
תרגיל לדוגמה
[עריכה]נתון :
- C קרח = 2.1 ג'אול/ג"ר*צלזיוס.
- C מים = 4.2 ג'אול/ג"ר*צלזיוס.
- C אדים 1.9 ג'אול/ג"ר*צלזיוס.
- ΔHm מים = 6kj/mole
- ΔHb מים = 40.7 kj/mole.
מהי כמות האנרגיה שיש להשקיע ב-50 ג"ר מים בטמפרטורה מינוס 20 מעלות צלזיוס בכדי להפוכם לאדים בטמפרטורה 120 מעלות צלזיוס?
תשובה
[עריכה]qΣ = A+B+C+D+E.
- A - מוצק.
- B - מעבר ממוצק לנוזל.
- והלאה.
חישוב :
- m = 50gr
- cקרח = 2.1 ג'אול/ג"ר*צלזיוס.
- ΔT = 0--20=20
- qA = 36*2.1*20/1000=1.5
- qb = ΔHm*n
- ΔHm = 6 kj/grc
- qb=6*2=12
וכך הלאה עבור כל אחד מהמצבים.
הערות
[עריכה]- שיטה זו מתאימה לתמיסות. כאשר מדובר בתמיסה אנו מניחים שתי הנחות :
- כמות האנרגיה שנפלטת או שנקלטה במערכת זהה לכמות האנרגיה שהקולט/פולט המומס ואין איבוד אנרגיה לכלי, למערכת ולסביבה.
- קיבול החום הסגולי של תמיסה מימית זהה למים.
- נתון נוסף חשוב : 100 מ"ל מים = 100 ג"ר מים.
חישוב גז
[עריכה]אנתלפית (אנרגיה) קשר - האנרגיה הדרושה לפירוק 1 מול מולקולה דו אטומית במצב גזי לאטומים בודדים; גם הם נמצאים במצב גזי (כאשר יש יותר משני מולים אטומים במולקולה; יש לחשב ע"פ אנתלפיית קשר ממוצעת).
- כששוברים קשר יש להשקיע אנרגיה.
- כשנוצר קשר מרוויחים אנרגיה.
דוגמה
[עריכה]כמה אנרגיה דרוש להשקיע בכדי לשבור את הקשר :
. אם בכדי לשבור את הקשרם הבאים יש להשקיע:
- H-H : 436
- Cl-Cl : 242
- H-Cl : 431.
פתרון
[עריכה]- נצייר את הקשר :
- נעזר בנוסחה : Hתוצר - Hמגיב = ΔH
- נציב בה : ΔH=436+242-2(431)=-184KJ
לכל מצבי הצבירה
[עריכה]חוק הס - חוזה את השינוי באנתלפיה בתגובה כימית. לפי החוק, מכיוון שהשינוי באנתלפיית התגובה הוא פונקציית מצב, השינוי באנתלפיה של תגובה הוא קבוע, בלי תלות בתגובות ביניים. לכן שלבי ביניים בתגובה הכימית אינם משפיעים על שינוי האנתלפיה.
דוגמה
[עריכה]| ΔH = -393.5KJ/mole | |
| ΔH = -285.9KJ/mole | |
| ΔH = -890.4KJ/mole | |
| ΔH = ? |
מה היא ΔH של התגובה?
דרך פתרון
[עריכה]א. סימון היסודות שרוצים (יש להבדיל בין מצבי הצבירה, מצב צברירה שונה מבטא "יסוד שונה")
| ΔH = -393.5KJ/mole | C(s) + O2(g)--->CO2(g) |
| ΔH = -285.9KJ/mole | H2(g) + 0.5O2(g) ---> H2O(l) |
| ΔH = -890.4KJ/mole | CH4(g)+2O2(g)--->CO2(g) + 2H2O |
| ΔH = ? | C(s)+2H2(g)--->CH4(g) |
ב. סימון + הכפלה של מה שחסר ולכן נרשום : 2H(g) + 0.5O2(g) ---> 2H2O(l)
- ΔH = -285.9*2 = -571.8KJ/mole
ג. נפטרים מהגורמים המיותרים במשוואה - כמו במערכת משוואות עם נעלמים במתמטיקה. במקרה שלנו נחבר את משוואה א' וב', ונחסיר אותן מג'. כאשר מבציעים פעולות על המשוואה לקבלת המשוואה רצויה (המשוואה האחרונה שנתונה, לה אין אנו יודעים את ΔH), מבצעים את אותן פעולות גם עבור ΔH.
פתרון : ΔH = -74.9KJ/mole.
מושגים נוספים
[עריכה]- אנתלפית אטומוזציה (ΔHa)-כמות האנרגיה הדרושה להעברת מול של אטומי יסוד ממצו התרקני (2.5C מעלות צלזיוס) למצב של גז אטומרי ב-25 מעלות צלזיוס.
- שקע = יון חופשי שוקע.
- אלטלתה = שבירת קשר.